- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:37.
- Viimati modifitseeritud 2025-06-01 07:36.
Peamine erinevus - metaan vs etaan
Metaan ja etaan on alkaanide perekonna väikseimad liikmed. Nende kahe orgaanilise ühendi molekulaarvalemid on vastav alt CH4 ja C2H6. Metaani ja etaani peamine erinevus on nende keemiline struktuur; etaani molekuli võib pidada kaheks metüülrühmaks, mis on ühendatud metüülrühmade dimeerina. Muud keemilised ja füüsikalised erinevused tulenevad peamiselt sellest struktuursest erinevusest.
Mis on metaan?
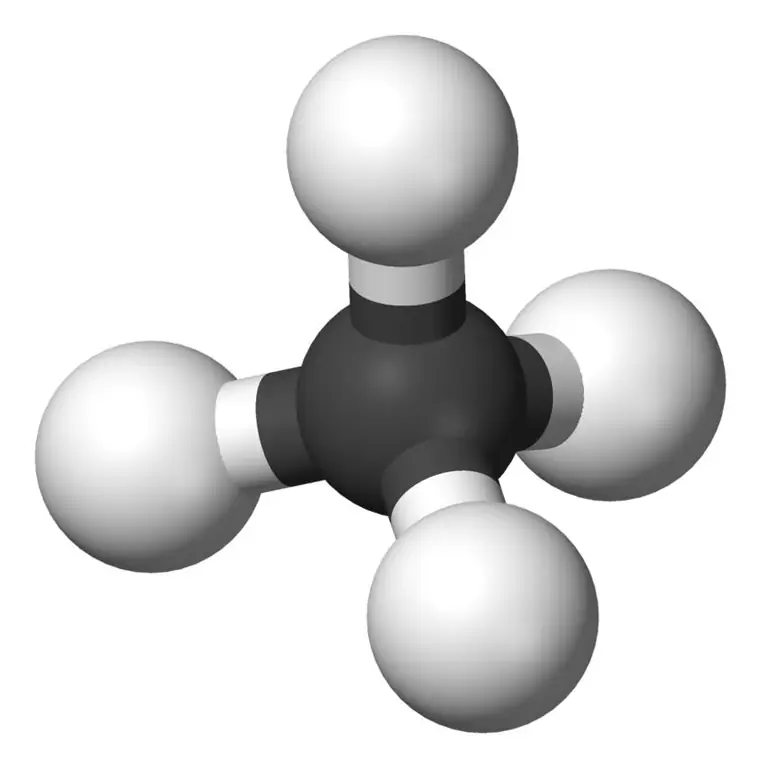
Metaan on alkaanide perekonna väikseim liige keemilise valemiga CH4(neli vesinikuaatomit on seotud ühe süsinikuaatomiga). Seda peetakse maagaasi peamiseks komponendiks. Metaan on värvitu, lõhnatu ja maitsetu gaas; tuntud ka kui karbaan, rabagaas, maagaas, süsiniktetrahüdriid ja vesinikkarbiid. Seda saab kergesti süttida ja selle aur on õhust kergem.
Metaani leidub looduslikult maa all ja merepõhja all. Atmosfääri metaani peetakse kasvuhoonegaasiks. Metaan laguneb koos veega atmosfääris CH3-.
Mis on Ethane?
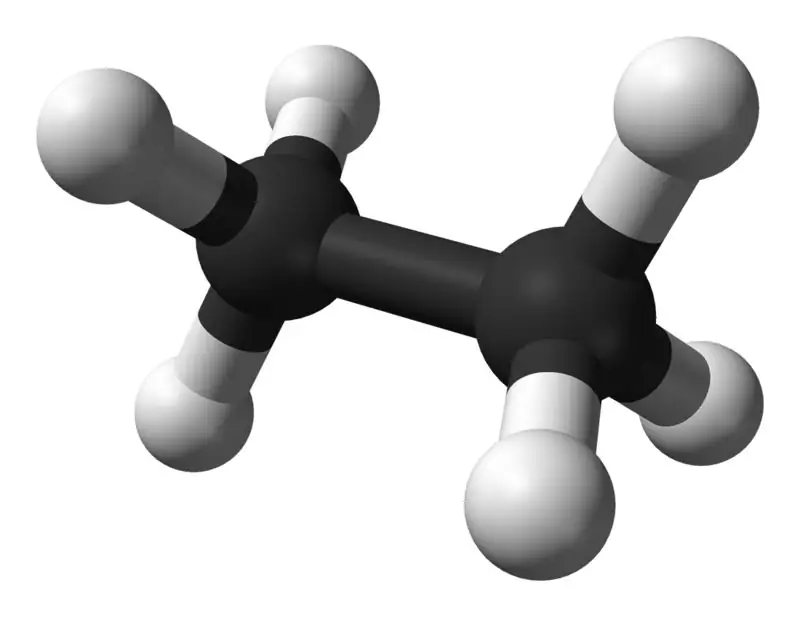
Etaan on standardtemperatuuril ja -rõhul värvitu lõhnatu gaasiline ühend. Selle molekulaarvalem ja molekulmass on vastav alt C2H6 ja 30,07 g·mol−1. See eraldatakse maagaasist nafta rafineerimise kõrvalsaadusena. Etaan on etüleeni tootmisel väga oluline.
Mis vahe on metaani ja etaani vahel?
Metaani ja etaani omadused
Struktuur:
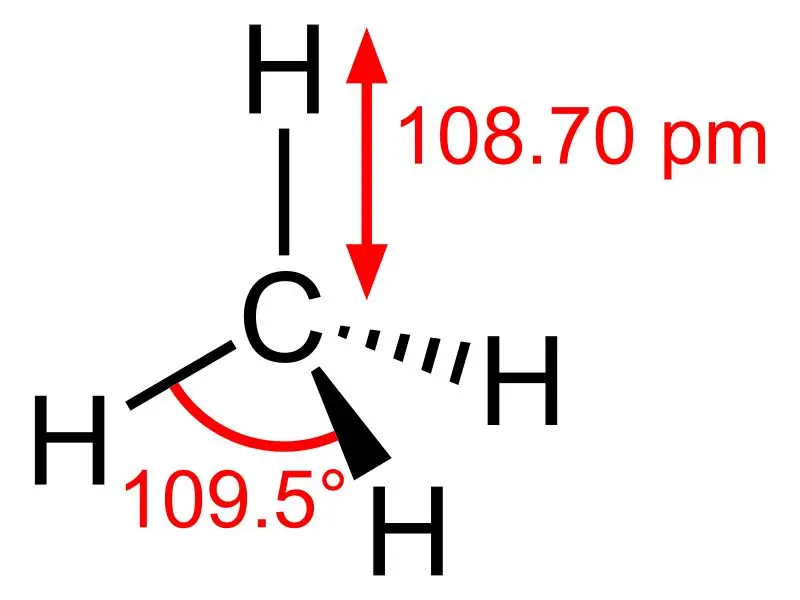
Metaan: metaani molekulvalem on CH4, ja see on näide tetraeedrilisest molekulist, millel on neli ekvivalentset C-H sidet (sigma side). Sidenurk H-C-H aatomite vahel on 109,50 ja kõik C-H sidemed on samaväärsed ning see on võrdne 108,70 pm.
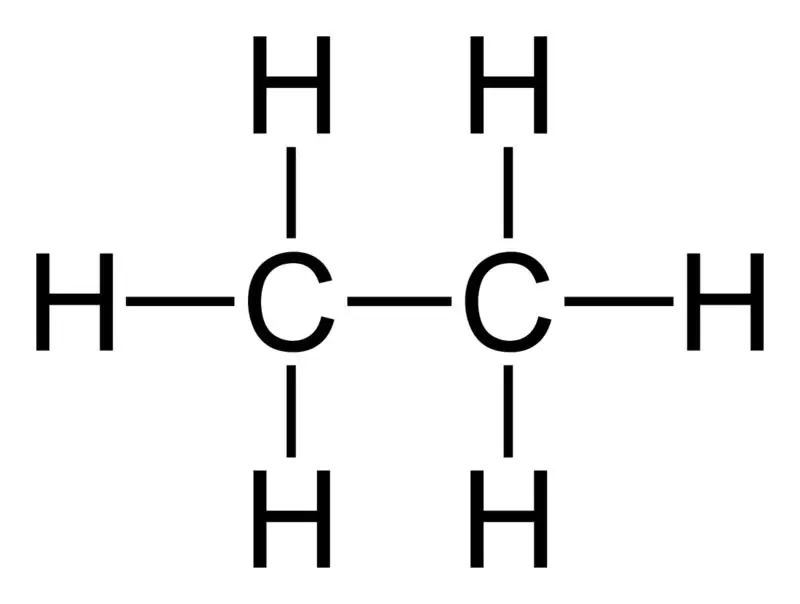
Etaan: etaani molekulvalem on C2H6,ja see on küllastunud süsivesinik, kuna see ei sisalda mitut sidet.
Keemilised omadused:
Metaan:
Stabiilsus: metaan on keemiliselt väga stabiilne molekul, mis ei reageeri KMnO4, K2Cr 2O7, H2SO4 või HNO 3 tavatingimustes.
Põlemine: liigse õhu või hapniku juuresolekul põleb metaan kahvatusinise mittevalguva leegiga, tekitades süsinikdioksiidi ja vett. See on väga eksotermiline reaktsioon; seetõttu kasutatakse seda suurepärase kütusena. Ebapiisava õhu või hapniku juuresolekul põleb see osaliselt süsinikmonooksiidi (CO) gaasiks.
Asendusreaktsioonid: Metaan näitab asendusreaktsioone halogeenidega. Nendes reaktsioonides asendatakse üks või mitu vesinikuaatomit võrdse arvu halogeeniaatomitega ja seda nimetatakse halogeenimiseks.” See reageerib päikesevalguse käes kloori (Cl) ja broomiga (Br).
Reaktsioon auruga: kui metaani ja auru segu lastakse läbi kuumutatud (1000 K) nikli, mis on kantud alumiiniumoksiidi pinnale, võib see toota vesinikku.
Pürolüüs: kui metaani kuumutatakse umbes 1300 K-ni, laguneb see tahmaks ja vesinikuks.
Etaan:
Reaktsioonid: Gaasiline etaan (CH3CH3) reageerib valguse juuresolekul broomiauruga, moodustades bromoetaani (CH). 3CH2Br) ja vesinikbromiid (HBr). See on asendusreaktsioon; vesinikuaatom etaanis on asendatud broomiaatomiga.
CH3CH3 + Br2 à CH3 CH2Br + HBr
Põlemine: etaani täielikul põlemisel tekib 1559,7 kJ/mol (51,9 kJ/g) soojust, süsinikdioksiidi ja vett.
2 C2H6 + 7 O2 → 4 CO 2 + 6 H2O + 3120 kJ
See võib toimuda ka ilma liigse hapnikuta, tekitades amorfse süsiniku ja süsinikmonooksiidi segu.
2 C2H6 + 3 O2 → 4 C + 6 H 2O + energia
2 C2H6 + 5 O2 → 4 CO + 6 H 2O + energia
2 C2H6 + 4 O2 → 2 C + 2 CO + 6 H2O + energia jne
Definitsioonid:
Asendusreaktsioonid: asendusreaktsioon on keemiline reaktsioon, mis hõlmab ühe funktsionaalrühma väljatõrjumist keemilises ühendis ja selle asendamist teise funktsionaalrühmaga.
Kasutused:
Metaan: metaani kasutatakse paljudes tööstuslikes keemilistes protsessides (kütusena, maagaasina, veeldatud maagaasina) ja seda transporditakse jahutatud vedelikuna.
Etaan: etaani kasutatakse mootorite kütusena ja külmutusagensina äärmiselt madala temperatuuriga süsteemis. Seda tarnitakse terassilindrites veeldatud gaasina oma aururõhu all.






