- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:37.
- Viimati modifitseeritud 2025-06-01 07:36.
Peamine erinevus - tugev ligand vs nõrk ligand
Ligand on aatom, ioon või molekul, mis loovutab või jagab kahte oma elektroni koordinaatse kovalentse sideme kaudu keskse aatomi või iooniga. Ligandide kontseptsiooni käsitletakse koordinatsioonikeemia all. Ligandid on keemilised liigid, mis osalevad metalliioonidega komplekside moodustamises. Seetõttu tuntakse neid ka kompleksimoodustajatena. Ligandid võivad ligandi denntisusest lähtuv alt olla ühe-, kahe-, kolmehambalised jne. Dentilisus on ligandis esinevate doonorrühmade arv. Monodentaat tähendab, et ligandil on ainult üks doonorrühm. Bidentate tähendab, et ühe ligandi molekuli kohta on kaks doonorrühma. Kristallivälja teooria alusel on liigitatud kahte peamist ligandide tüüpi; tugevad ligandid (või tugeva välja ligandid) ja nõrgad ligandid (või nõrga välja ligandid). Peamine erinevus tugevate ja nõrkade ligandide vahel on see, et orbitaalide lõhenemine pärast tugeva välja ligandiga seondumist põhjustab suurema erinevuse kõrgema ja madalama energiatasemega orbitaalide vahel, samas kui orbitaalide lõhenemine pärast nõrga välja ligandiga seondumist põhjustab väiksema erinevuse kõrgema ja madalama energiataseme orbitaalide vahel.
Mis on kristallivälja teooria?
Kristallide väljateooriat võib kirjeldada kui mudelit, mis on loodud selgitama elektronide orbitaalide (tavaliselt d või f orbitaalide) degeneratsiooni (võrdse energiaga elektronkestad) purunemist ümbritseva keskkonna tekitatud staatilise elektrivälja tõttu. anioon või anioonid (või ligandid). Seda teooriat kasutatakse sageli siirdemetalliioonide komplekside käitumise demonstreerimiseks. See teooria võib selgitada magnetilisi omadusi, koordinatsioonikomplekside värve, hüdratsiooni entalpiat jne.
Teooria:
Metalliiooni ja ligandide vaheline interaktsioon tuleneb positiivse laenguga metalliiooni ja ligandi paaritute elektronide negatiivse laengu vahelisest külgetõmbest. See teooria põhineb peamiselt muutustel, mis toimuvad viiel degenereerunud elektroni orbitaalil (metalliaatomil on viis d-orbitaali). Kui ligand satub metalliioonile lähedale, on paardumata elektronid mõnele d-orbitaalile lähemal kui metalliiooni teistele d-orbitaalidele. See põhjustab degeneratsiooni kadumise. Ja ka d-orbitaalidel olevad elektronid tõrjuvad ligandi elektrone (kuna mõlemad on negatiivse laenguga). Seega on ligandile lähemal olevatel d-orbitaalidel kõrge energia kui teistel d-orbitaalidel. Selle tulemuseks on d-orbitaalide jagunemine suure energiaga d-orbitaalideks ja madala energiaga d-orbitaalideks, mis põhinevad energial.
Mõned seda jagamist mõjutavad tegurid on; metalliiooni olemus, metalliiooni oksüdatsiooniaste, ligandide paigutus keskse metalliiooni ümber ja ligandide olemus. Pärast nende d-orbitaalide energiapõhist jagamist tuntakse kõrge ja madala energiaga d-orbitaalide erinevust kristallivälja jagamise parameetrina (∆oct oktaeedriliste komplekside puhul).
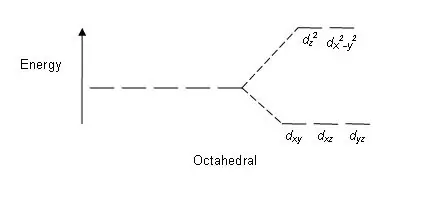
Joonis 01: Lõhestusmuster oktaeedrilistes kompleksides
Jagamismuster: kuna d-orbitaale on viis, toimub poolitamine vahekorras 2:3. Oktaeedrilistes kompleksides on kaks orbitaali kõrgel energiatasemel (nimetatakse ühiselt "nt") ja kolm orbitaali on madalamal energiatasemel (ühinimega t2g). Tetraeedrilistes kompleksides toimub vastupidine; kolm orbitaali on kõrgemal energiatasemel ja kaks madalamal energiatasemel.
Mis on tugev ligand?
Tugev ligand või tugeva välja ligand on ligand, mille tulemuseks võib olla suurem kristallivälja lõhenemine. See tähendab, et tugeva välja ligandi sidumine põhjustab suurema erinevuse kõrgema ja madalama energiataseme orbitaalide vahel. Näited hõlmavad CN- (tsüaniidligandid), NO2- (nitroligand) ja CO (karbonüül) ligandid).
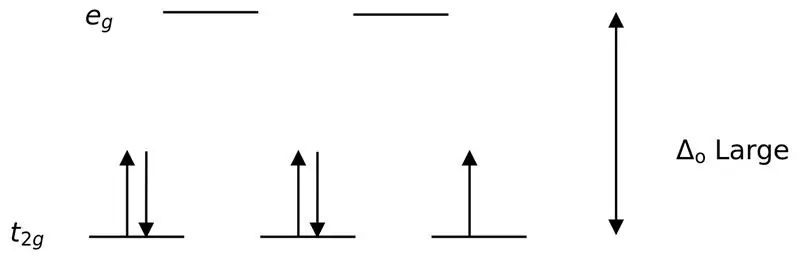
Joonis 02: Madala spinni lõhenemine
Nende ligandidega komplekside moodustamisel täidetakse madalama energiaga orbitaalid (t2g) algul täielikult elektronidega, enne kui need täituvad mis tahes muule kõrge energiatasemega orbitaalile (nt). Sel viisil moodustunud komplekse nimetatakse "madala spinni kompleksideks".
Mis on nõrk ligand?
Nõrk ligand või nõrga välja ligand on ligand, mis võib põhjustada väiksema kristallivälja lõhenemist. See tähendab, et nõrga välja ligandi sidumine põhjustab madalamat erinevust kõrgema ja madalama energiataseme orbitaalide vahel.
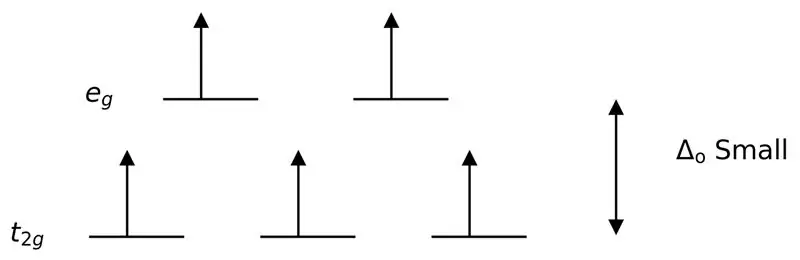
Joonis 3: Suure pöördega poolitamine
Sel juhul, kuna kahe orbitaalitaseme väike erinevus põhjustab nendel energiatasemetel elektronide vahel tõuke, saab kõrgema energiaga orbitaale kergemini täita elektronidega võrreldes madala energiatasemega orbitaalidega. Nende ligandidega moodustunud komplekse nimetatakse "kõrge spinni kompleksideks". Nõrga välja ligandide näideteks on I- (jodiidligand), Br- (bromiidligand) jne.
Mis vahe on tugeval ja nõrgal ligandil?
Tugev ligand vs nõrk ligand |
|
| Tugev ligand või tugeva välja ligand on ligand, mille tulemuseks võib olla suurem kristallivälja lõhenemine. | Nõrk ligand või nõrga välja ligand on ligand, mis võib põhjustada väiksema kristallivälja lõhenemist. |
| Teooria | |
| Tugeva välja ligandi sidumise järgne lõhenemine põhjustab suurema erinevuse kõrgema ja madalama energiataseme orbitaalide vahel. | Orbitaalide lõhenemine pärast nõrga välja ligandi sidumist põhjustab väiksema erinevuse kõrgema ja madalama energiatasemega orbitaalide vahel. |
| Kategooria | |
| Tugevate väljaligandidega moodustunud komplekse nimetatakse "madala spinni kompleksideks". | Nõrga välja ligandidega moodustunud komplekse nimetatakse "kõrge spinni kompleksideks". |
Kokkuvõte - tugev ligand vs nõrk ligand
Tugevad ligandid ja nõrgad ligandid on anioonid või molekulid, mis põhjustavad metalliiooni d-orbitaalide lõhenemist kaheks energiatasemeks. Erinevus tugevate ligandide ja nõrkade ligandide vahel seisneb selles, et lõhenemine pärast tugeva välja ligandi sidumist põhjustab suurema erinevuse kõrgema ja madalama energiatasemega orbitaalide vahel, samas kui orbitaalide lõhenemine pärast nõrga välja ligandi sidumist põhjustab väiksema erinevuse kõrgema ja madalama energiataseme vahel. energiataseme orbitaalid.






