- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:37.
- Viimati modifitseeritud 2025-06-01 07:36.
Põhiline erinevus alfa- ja beetaheeliksi vahel sõltub nende struktuuride väljatöötamisel tekkiva vesiniksideme tüübist. Alfa-heeliksid moodustavad molekulisiseseid vesiniksidemeid, beeta-heeliksid aga molekulidevahelisi vesiniksidemeid.
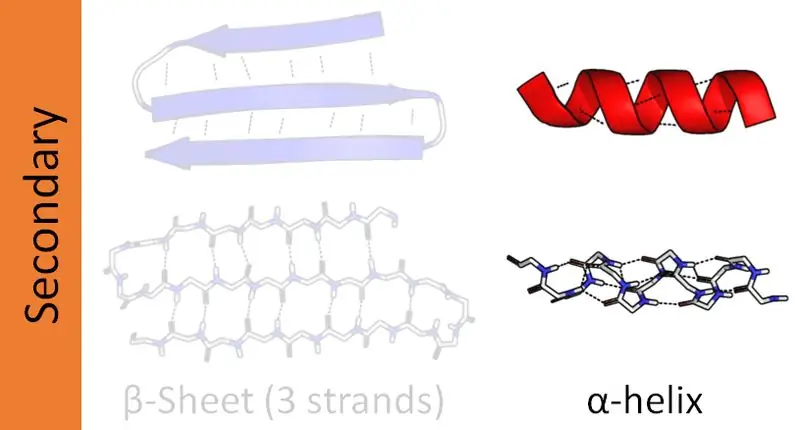
Keerulistel valkudel on neli struktuurset organisatsioonilist taset - esmane, sekundaarne, tertsiaarne ja kvaternaarne. Valkude sekundaarstruktuurid moodustavad erinevas orientatsioonis peptiidahelaid. Peptiidahelad koosnevad aminohappejärjestustest, mis on seotud peptiidsidemetega. Seetõttu on valkudes kaks peamist sekundaarset struktuuri nagu alfa- ja beetaheeliks. Lisaks on ka teisi sekundaarstruktuure, mida nimetatakse beetapöörde- ja juuksenõelastruktuurideks. Peamiselt keskendub see artikkel alfa- ja beetaheeliksi erinevusele.
Mis on Alpha Helix?
Valkudel on neli struktuurilist organiseerituse taset. Neist alfaheeliks on valkude levinum sekundaarstruktuur. Ja see struktuur näib olevat varras, mis on keritud ümber kesktelje. Lisaks on alfaheeliks parempoolne spiraal. Samas võisid esineda ka vasakukäelised heliksid. Siin moodustuvad peptiidsidemed amino-otsast karboksü-otsani. Aminohapped seostuvad üksteisega nende peptiidsidemete kaudu. Molekulidesisesed vesiniksidemed on alfa-heeliksi moodustumise peamine põhjus.
Joonis 01: Alpha Helix
Alfa-heeliksi paigutus sõltub valgu hüdrofiilsest ja hüdrofoobsest olemusest. Kui aminohappejärjestus koosneb suurest arvust hüdrofiilsetest R (muutuvatest) rühmadest, orienteeruvad R-rühmad vesifaasile. Kui varieeruvad rühmad on hüdrofoobsed, ulatuvad nad keskkonna hüdrofoobsesse faasi. Mõlema stsenaariumi korral näivad R-rühmad ulatuvat spiraalsest struktuurist välja. Nende struktuuriomaduste tõttu on alfaheeliks mutatsioonide suhtes vastupidavam. Seega stabiliseerib vesiniksidemete olemasolu alfa-heeliksi struktuuri. Alfaheeliksis on pöörde kohta keskmiselt 3,6 jääki, kuna vesiniksidemete tekkeks kulub 3,6 jääki. Mõned struktuurvalgud, nagu kollageen ja keratiin, sisaldavad rikkalikult alfa-heelikse.
Mis on Beta Helix?
Beetaheeliks on valgu levinuim sekundaarstruktuur. Kuigi see ei ole nii levinud kui alfa-heeliks, mängib beetaheeliksite olemasolu ka valgu struktuuris olulist rolli. Beeta-heeliksi moodustumine toimub kahe beeta-lehe kaudu, mis on paigutatud kas paralleelselt või antiparalleelselt. Seejärel moodustuvad need lehed spiraalseks struktuuriks. Molekulidevahelised vesiniksidemed kahe kihi vahel aitavad moodustada beetaheeliksit.

Joonis 02: Beta Helix
Beeta-heeliksid võivad olla nii parema- kui ka vasakukäelised, olenev alt nende sidumismustrist. Beeta-heeliksi moodustamisel paiknevad kahe beeta-lehe muutuvad rühmad spiraali südamikus. Seetõttu on enamikul beetalehti moodustavatest rühmadest hüdrofoobsed funktsioonid.
Vastupidiselt alfa-heeliksile moodustavad 17 jääki beetaheeliksites ühe pöörde. Metalliioonidel on võime aktiveerida beetaheeliksi moodustumist. Sarnaselt alfa-heeliksiga toetavad vesiniksidemed beetaheeliksi struktuuri säilitamist. Süsinikanhüdraasi ensüüm ja pektaatlüaas on kaks valku, mis on rikkad beeta-heeliksitest.
Millised on alfa- ja beetahelixi sarnasused?
- Alfa ja beetaheeliks on valkude kaks sekundaarset struktuuri.
- Aminohapped on mõlema sekundaarstruktuuri monomeerid.
- Lisaks on alfa- ja beetaheeliksite keemilised koostisosad süsinik, vesinik, hapnik, lämmastik ja väävel.
- Samuti arenevad mõlemad sekundaarsed struktuurid kõrgema taseme organisatsiooniks.
- Lisaks on mõlemad stabiliseeritud vesiniksidemetega.
- Mõlema struktuuri puhul määrab hüdrofoobsuse aminohapete R-rühmade olemasolu.
Mis vahe on alfa- ja beetaheliksil?
Põhiline erinevus alfa- ja beetaheeliksi vahel on nende vesiniksideme tüüp. Alfa-heeliksil on molekulidevaheline vesinikside, beeta-heeliksil aga molekulidevaheline vesinikside. Lisaks moodustab alfa-heeliks parempoolse spiraali, beeta-heeliks aga nii parem- kui ka vasakukäelise spiraali. Seega on see ka oluline erinevus alfa- ja beetaheeliksi vahel.
Lisaks on alfa- ja beetaheeliksi erinevus veel selles, et alfa-heeliksi moodustumine toimub aminohappejärjestuse keerdumisel, samas kui beeta-heeliksi moodustumisel on kaks paralleelset või antiparalleelset beeta-lehte seotud moodustavad spiraalse struktuuri.
Allpool olev infograafik annab rohkem teavet alfa- ja beetaspiraali erinevuse kohta.

Kokkuvõte - alfa vs beetahelix
Nii alfa- kui ka beetaheeliksid on olulised keeruliste valgustruktuuride tuvastamisel ja tuletamisel. Mõlemad tüübid on valkude sekundaarsed struktuurid. Alfaheeliks on aga aminohapete järjestuste spiraalne keerd. Seevastu beetaheeliksi moodustumine toimub paralleelsete või antiparalleelsete beetalehtede vesiniksideme kaudu. Veelgi enam, vesinikside on molekulisisene alfa-heeliksi kujul, samas kui vesinikside on molekulidevaheline beeta-heeliksi kujul. Lisaks on mõlemal struktuuril R-rühm, mis määrab valgu hüdrofoobsuse. Seega võtab see alfa- ja beetaheeliksi erinevuse kokku.






