- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:37.
- Viimati modifitseeritud 2025-06-01 07:36.
Põhiline erinevus lämmastikmonooksiidi ja dilämmastikpentoksiidi vahel on see, et lämmastikmonooksiid on värvitu gaas, samas kui lämmastikpentoksiid on valge tahke aine.
Lämmastikmonooksiid ja lämmastikpentooksiid on lämmastikku ja hapnikku sisaldavad keemilised ühendid. Need on lämmastikoksiidid. Neil on aga erinevad keemilised ja füüsikalised omadused.
Mis on lämmastikmonooksiid?
Lämmastikmonooksiid on anorgaaniline ühend keemilise valemiga NO. Me nimetame seda lämmastikoksiidiks, kuna see on lämmastikoksiid. See on tegelikult vaba radikaal, kuna sellel on paaritu elektron. Pealegi on see heteronukleaarne kaheaatomiline molekul.
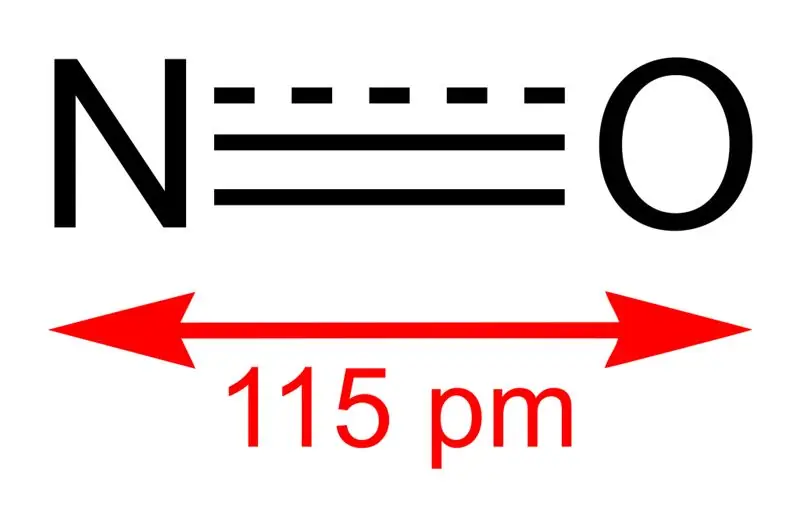
Joonis 01: Lämmastikmonooksiidi struktuur ja sideme pikkus N ja O vahel
Selle ühendi molaarmass on 30 g/mol. See esineb värvitu gaasina. Lisaks on selle sulamistemperatuur -164 °C ja keemistemperatuur -152 °C, mis on teiste lämmastikoksiidide omadega võrreldes väga väikesed väärtused. Seda vaba radikaali saame toota ammoniaagi oksüdeerimisel 850 °C juures plaatinakatalüsaatori juuresolekul. Laboratoorses mastaabis saame seda valmistada lahjendatud lämmastikhappe redutseerimisel vasega.
Mis on dilämmastikpentoksiid?
Dinitrogenpentoksiid on anorgaaniline ühend, mille keemiline valem on N2O5 Me nimetame seda lämmastikpentoksiidiks. See on binaarne lämmastikoksiid. Lisaks on see ebastabiilne ja võib toimida ohtliku oksüdeerijana. Ühendi molaarmass on 108,01 g/mol. See on valge tahke aine.
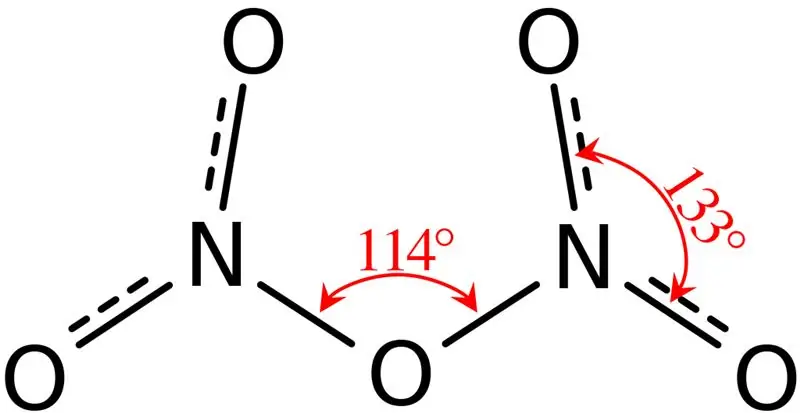
Joonis 02: Dilämmastikpentoksiidi struktuur
Lisaks on selle ühendi sulamistemperatuur 41 °C ja temperatuuril 47 °C see ühend sublimeerub. See ühend reageerib veega, andes lämmastikhappe. Lisaks on dilämmastikpentoksiidi molekuli molekulaarne kuju tasapinnaline. Seda ühendit saame toota lämmastikhappe dehüdraatimisel fosforpentoksiidiga.
Mis vahe on lämmastikmonooksiidil ja dilämmastikpentoksiidil?
Lämmastikmonooksiid on anorgaaniline ühend keemilise valemiga NO, samas kui dilämmastikpentoksiid on anorgaaniline ühend keemilise valemiga N2O5 Peamine erinevus lämmastikmonooksiidi ja dilämmastikpentoksiidi vahel on see, et lämmastikmonooksiid on värvitu gaas, samas kui lämmastikpentoksiid on valge tahke aine. Lisaks saame toota lämmastikmonooksiidi ammoniaagi oksüdeerimisel temperatuuril 850 °C plaatina katalüsaatori juuresolekul. Dilämmastikpentoksiidi tootmine toimub aga lämmastikhappe dehüdreerimisel fosforpentoksiidiga. Molekuli kuju arvestades on lämmastikmonooksiid lineaarne, lämmastikpentoksiid aga tasane.
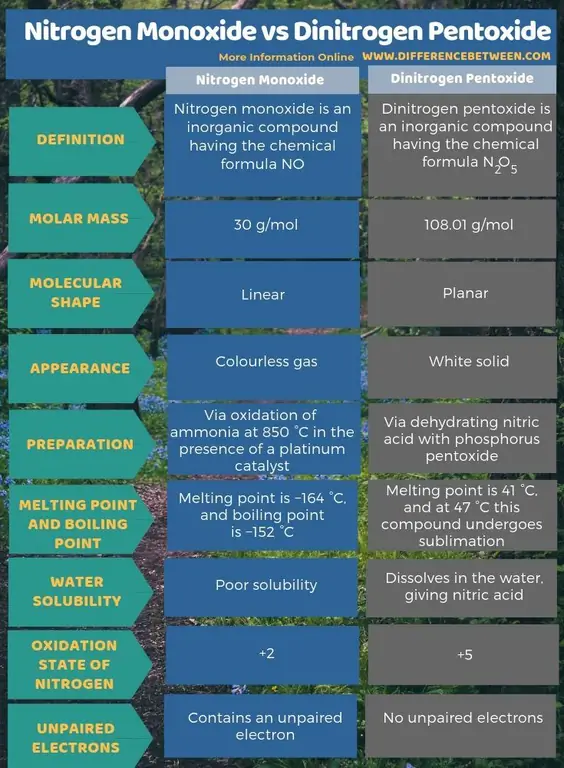
Kokkuvõte - lämmastikmonoksiid vs lämmastikpentoksiid
Lämmastikmonooksiid on anorgaaniline ühend keemilise valemiga NO, samas kui dilämmastikpentoksiid on anorgaaniline ühend keemilise valemiga N2O5 Peamine erinevus lämmastikmonooksiidi ja dilämmastikpentoksiidi vahel on see, et lämmastikmonooksiid on värvitu gaas, samas kui lämmastikpentoksiid on valge tahke aine.






