- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:37.
- Viimati modifitseeritud 2025-06-01 07:36.
Süsihappe ja vesinikkarbonaadi peamine erinevus seisneb selles, et süsihape on neutraalne keemiline ühend, samas kui vesinikkarbonaat on negatiivselt laetud keemiline ühend.
Süsinikhape on nõrk hape, mis moodustub lahuses, kui süsinikdioksiid lahustub vees ja mille keemiline valem on H2CO3. Bikarbonaat moodustub kolme hapnikuaatomi, vesinikuaatomi ja süsinikuaatomi kombinatsioonil keemilise valemiga HCO3-.
Mis on süsihape?
Süsinikhape on H2CO3. Mõnikord anname selle nime lahustele, mis sisaldavad vees või gaseeritud vees lahustunud süsinikdioksiidi. Seda seetõttu, et gaseeritud vesi sisaldab vähesel määral H2CO3. Lisaks on süsihape nõrk hape ja see võib moodustada kahte tüüpi sooli nagu karbonaadid ja vesinikkarbonaadid. Selle ühendi molaarmass on 62,024 g/mol.
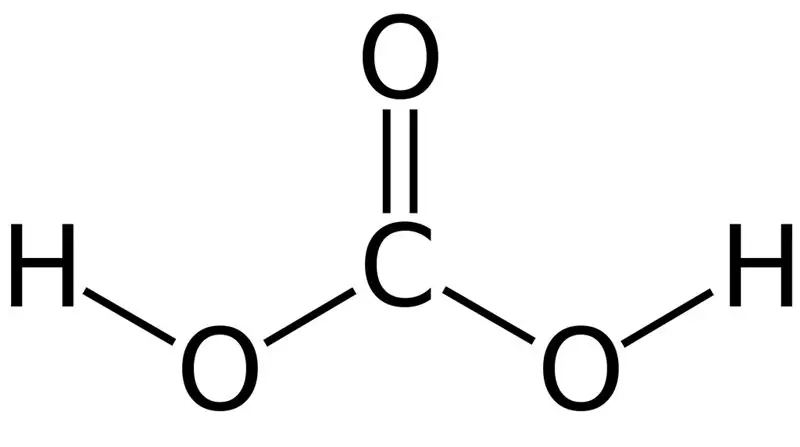
Joonis 01: Süsinikhappe keemiline struktuur
Kui süsihappegaas lahustub vees, satub see tasakaalu süsinikdioksiidi ja süsihappe vahel. Tasakaal on järgmine:
CO2 + H2O ⟷ H2CO3
Kui lisame alusele liigse süsihappe, annab see bikarbonaadi. Kuid kui alust on liiga palju, kipub süsihape andma gaseeritud sooli. Täpsem alt on süsihape karboksüülhappeühend, millel on kaks hüdroksüülrühma asendajat, mis on seotud karbonüülsüsinikuga. Lisaks on see polüprootne hape, mis on võimeline prootoneid loovutama. Sellel on kaks eemaldatavat prootonit, seega on see spetsiifiliselt diprootne.
Mis on vesinikkarbonaat?
Bikarbonaat moodustub kolme hapnikuaatomi, vesinikuaatomi ja süsinikuaatomi kombinatsioonil. Selle kombinatsiooni saadus võib olla ioon või ühend, milles on rohkem elektrone kui prootoneid. Me võime seda kirjeldada kui keemilist liiki, mille keemiline valem on HCO3-.
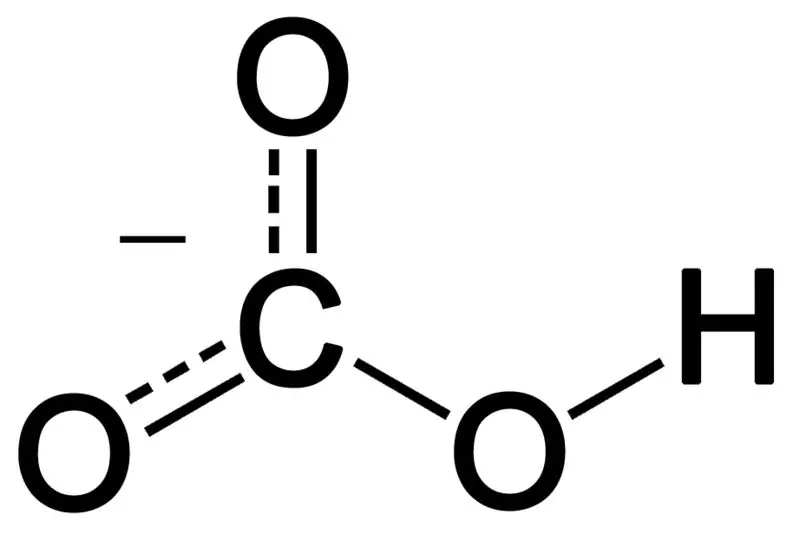
Joonis 02: Bikarbonaataniooni keemiline struktuur
See ühend on võhiklikult öeldes oluline osa keha pH-puhversüsteemist: see vastutab vere hoidmise eest, mis ei ole liiga happeline ega liiga aluseline. Lisaks on see vahend seedemahlade kontrolli all hoidmiseks, kui magu on toidu seedimise lõpetanud. Lisaks moodustab vihmavees sisalduv süsihape kividega kokku puutudes vesinikkarbonaadi ioone. See vesinikkarbonaadiioonide voog on oluline süsinikuringe käigushoidmisel.
Mis vahe on süsihappel ja vesinikkarbonaadil?
Süsinikhape on nõrk hape, mis moodustub lahuses, kui süsinikdioksiid lahustub vees, ja selle keemiline valem on H2CO3. Bikarbonaat moodustub kolme hapnikuaatomi, vesinikuaatomi ja süsinikuaatomi kombinatsioonil keemilise valemiga HCO3-. Peamine erinevus süsihappe ja vesinikkarbonaadi vahel on see, et süsihape on neutraalne keemiline ühend, samas kui vesinikkarbonaat on negatiivselt laetud keemiline ühend. Veelgi enam, süsihapet kasutatakse mullitavate ja kihisevate jookide valmistamisel, dermatiidide ravimisel, suuvees jne, vesinikkarbonaati aga toiduainetes, näiteks küpsetistes (kergitusainena) ja see annab võime seista vastu pH muutustele.
Järgmine infograafik võtab süsihappe ja vesinikkarbonaadi erinevuse tabelina kõrvuti võrdlemiseks.
Kokkuvõte - süsihape vs vesinikkarbonaat
Süsinikhape on H2CO3. Bikarbonaat moodustub kolme hapnikuaatomi, vesinikuaatomi ja süsinikuaatomi kombinatsioonis keemilise valemiga HCO3-. Peamine erinevus süsihappe ja vesinikkarbonaadi vahel on see, et süsihape on neutraalne keemiline ühend, samas kui vesinikkarbonaat on negatiivselt laetud keemiline ühend.






